QUIMICA
martes, 18 de noviembre de 2014
lunes, 17 de noviembre de 2014
PERIODOS Y GRUPOS DE LA TABLA PERIODICA
La tabla periodica actual o sistema periodico es una expresion de las relaciones que existen entre los elementos quimicos que se organizan el filas horizontales llamadas : periodos y columnas llamadas : grupos
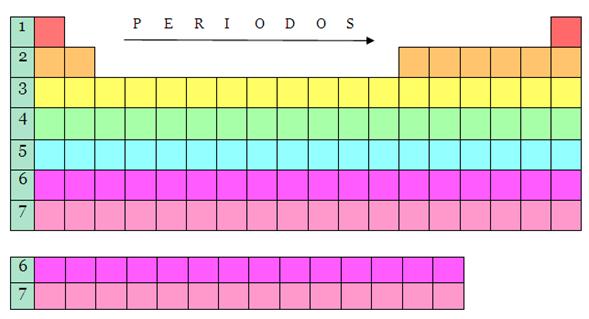
PERIODOS
Existen 7 periodos .el numero de elementos de cada periodo no es fijo:Asi el primer periodo tiene 2 elementos el segundo y el tercero periodo tienen 8 elementos el cuarto y quinto periodo tienen 18 elementos cada uno el sexto periodo es muy largo esta contiene 32 elementos el septimo contiene 29 elementos
GRUPOS
Existen 18 grupos o familias de estos 8 sonlargos y 10 son cortos y se situan el el centro de la tabla .En la parte superior de cada columna hay un numero romano que se asigna a cada grupo .Los elementos de las 2 primeras columnas de la izquierda y las seis ultimas a la derechase denominan familias principales y se les asignan le letra Amientras que los elementos que se ubican en el centro de la tabla se los conoce como elementos de traanscision y se les designa la letra B
VIDEO SOBRE EL TEMA VISTO :
PERIODOS
Existen 7 periodos .el numero de elementos de cada periodo no es fijo:Asi el primer periodo tiene 2 elementos el segundo y el tercero periodo tienen 8 elementos el cuarto y quinto periodo tienen 18 elementos cada uno el sexto periodo es muy largo esta contiene 32 elementos el septimo contiene 29 elementos
GRUPOS
Existen 18 grupos o familias de estos 8 sonlargos y 10 son cortos y se situan el el centro de la tabla .En la parte superior de cada columna hay un numero romano que se asigna a cada grupo .Los elementos de las 2 primeras columnas de la izquierda y las seis ultimas a la derechase denominan familias principales y se les asignan le letra Amientras que los elementos que se ubican en el centro de la tabla se los conoce como elementos de traanscision y se les designa la letra B
martes, 4 de noviembre de 2014
DISTRIBUCION ELECTRONICA
cada elemento tiene una configuracion electronica caracteristica que muestra como se disponen los electrones alrededor del nucleo.
Para escribir el modo en el que se disponen los electrones para llenar los orbitales atomicos , se debe tomar en cuenta tres reglas:
1. Principio de Aufbau
los electrones se acomodan en funcion creciente de su energia
2. Principio de exclusion de Pauli
Establece que en un orbital atomico caben , como maximo, dos electrones con espines opuestos .
Tambien predice que ningun electron de un mismo atomo puede tener los cuatro numeros cuanticos iguales
3. Regla de Hund
Cuando varios elecctrones ocupan orbitales de igual energia se dispone de manera que se llena la mitad del subnivel con electrones de spin +1/2 , para luego proceder a llenar los subniveles con electrones de spin contrario -1/2
Suscribirse a:
Entradas (Atom)